Поиск новых молекулярных мишеней для повышения толерантности сердца к ишемии-реперфузии - актуальная задача современной сердечно-сосудистой фармакологии и физиологии. Одним из перспективных направлений этого поиска является выявление механизмов формирования устойчивости миокарда к ишемическим и реперфузионным повреждениям сердца, возникающей в результате адаптирующих воздействий (таких как хроническая умеренная гипоксия, адаптация к холоду, умеренные физические и стрессовые нагрузки), с целью последующего фармакологического стимулирования этих мишеней. Создание принципиально новых лекарственных препаратов на основе этих механизмов позволит ограничить размер инфаркта и, как следствие, спасти жизнь пациентов.
Исследования ученых лаборатории экспериментальной кардиологии НИИ кардиологии Томского НИМЦ в 2022-2024 гг, которые проводились при поддержке гранта РНФ №22-15-00048, показали, что одним из механизмов реализации адаптационной устойчивости миокарда к ишемии, в том числе при метаболическом синдроме, является активация мю-опиоидных рецепторов. В 2025 году эти исследования были продолжены и посвящены верификации выявленной молекулярной мишени для кардиопротекции – активации мю-опиоидных рецепторов селективными агонистами.
- Мю-1 и мю-2 опиоидные рецепторы – это белковые молекулы, расположенные на мембранах клеток, которые селективно взаимодействуют с агонистами пептидной и непептидной природы и передают сигнал внутрь клетки.
- Сложность исследований в этом направлении представляет трансляция полученных результатов, когда кардиопротекторные молекулы тестируются на здоровых лабораторных животных, а должны применяться для лечения пациентов с многочисленными сопутствующими заболеваниями. В частности, большая часть пациентов кардиологического профиля имеет инсулинорезистентность, абдоминальное ожирение (жир в области талии), высокое артериальное давление и дислипидемии. Этот комплекс нарушений называют метаболическим синдромом. Он значительно увеличивает риск развития сердечно-сосудистых заболеваний, таких как инфаркт и инсульт, и сахарного диабета 2 типа. В нашем исследовании перспективные молекулы для кардиопротекции тестировали как на здоровых крысах, так и на крысах с диета-индуцированным метаболическим синдромом, - рассказала руководитель проекта, ведущий научный сотрудник лаборатории экспериментальной кардиологии НИИ кардиологии Томского НИМЦ, доктор мед. наук Наталья Нарыжная.
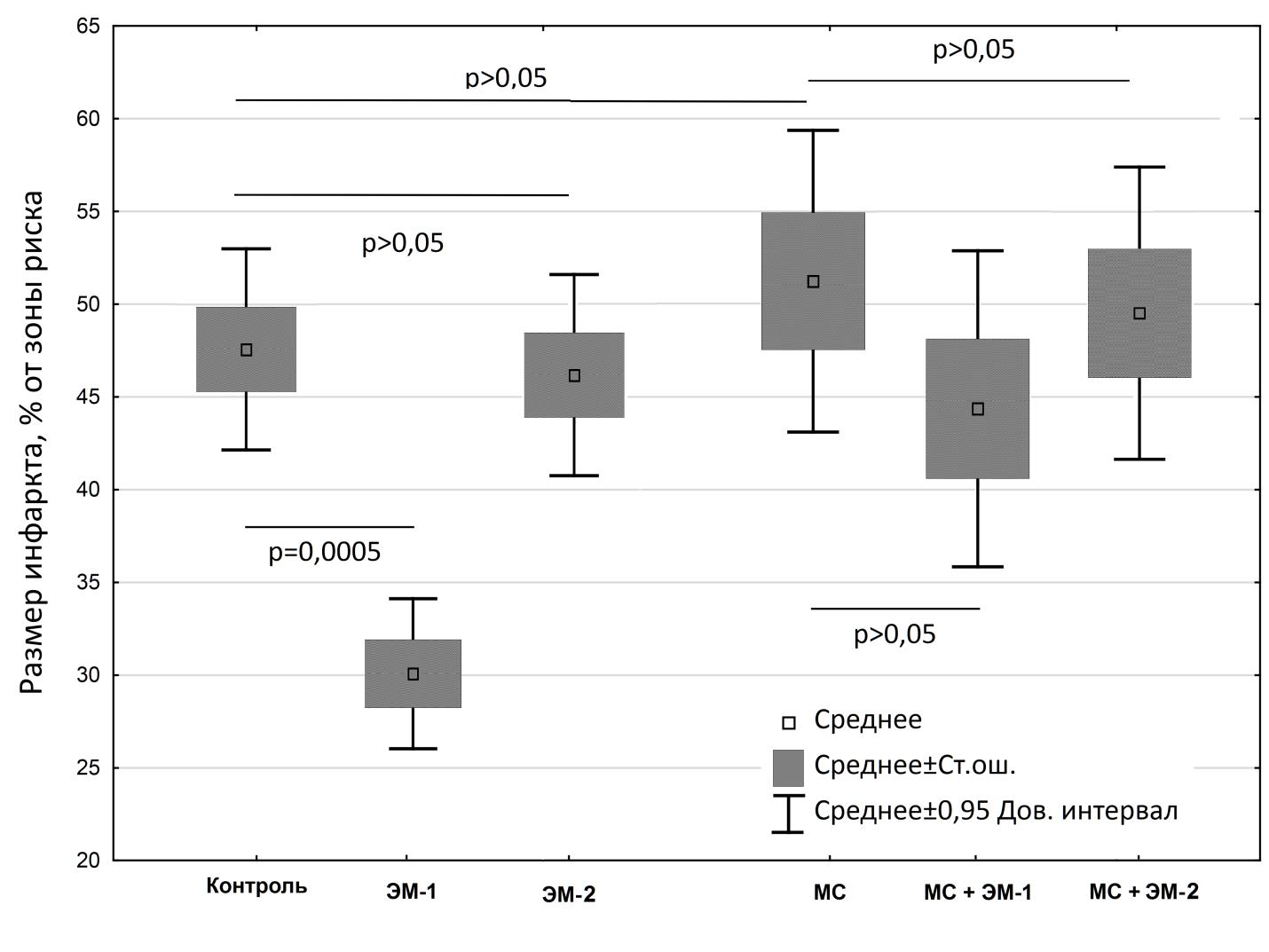 На рисунке: Инфаркт-лимитирующая эффективность агониста мю-2 опиоидных рецепторов эндоморфина-1 и мю-1 опиоидных рецепторов эндоморфина-2 у крыс при метаболическом синдроме и без него. р – значимость различий, ANOVA апостериорный критерий Тьюки. МС – диета-индуцированный метаболический синдром; ЭМ-1 – эндоморфин-1, ЭМ-2 – эндоморфин-2.
На рисунке: Инфаркт-лимитирующая эффективность агониста мю-2 опиоидных рецепторов эндоморфина-1 и мю-1 опиоидных рецепторов эндоморфина-2 у крыс при метаболическом синдроме и без него. р – значимость различий, ANOVA апостериорный критерий Тьюки. МС – диета-индуцированный метаболический синдром; ЭМ-1 – эндоморфин-1, ЭМ-2 – эндоморфин-2.
Исследователи выявили, что селективный агонист мю2-ОР эндоморфин-1, в отличие от агониста и мю-1-ОР эндоморфина-2, является перспективным соединением для кардиопротекции. Однако его эффективность при метаболическом синдроме снижена. Дальнейшие исследования будут направлены на выявление причин низкой эффективности эндоморфина-1 при метаболическом синдроме и выявлению взаимосвязей между отдельными компонентами метаболического синдрома – высоким артериальным давлением, дислипидемией, нарушениями углеводного обмена.
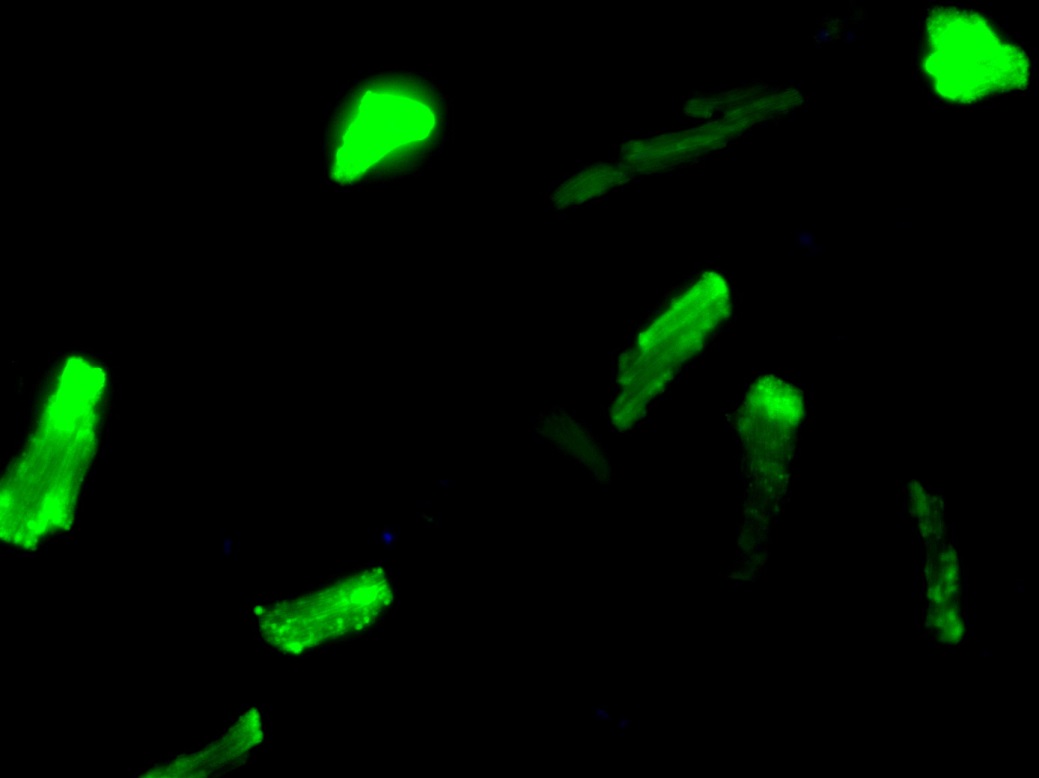
На рисунке: Активные формы кислорода в кардиомиоцитах после гипоксии/реоксигенации. Флуоресцентное окрашивание in vivo 2′,7′-дихлорфлуоресцеином, увеличение х400.
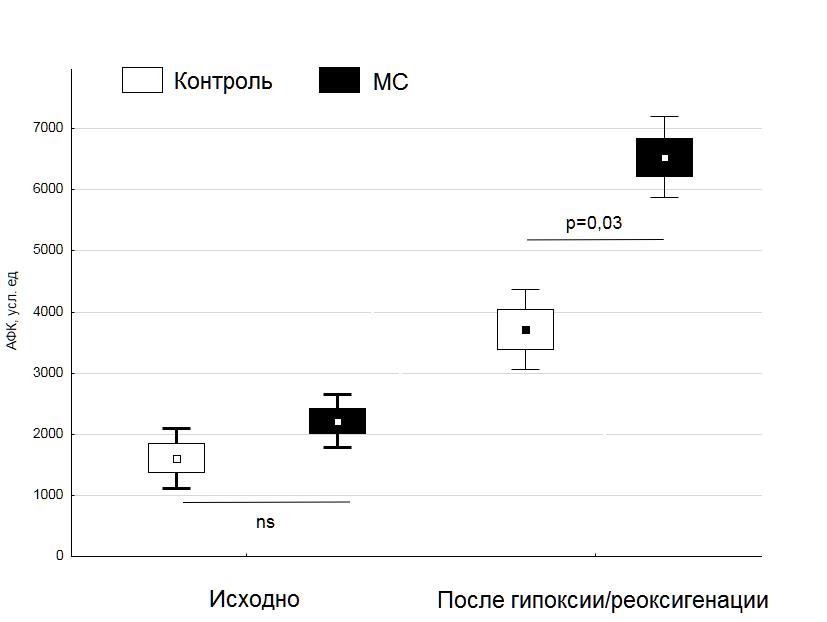
На рисунке: Влияние метаболического синдрома на образование активных форм кислорода в кардиомиоцитах крыс при гипоксии-реоксигенации. МС – диета-индуцированный метаболический синдром.
Также ученые обнаружили, что метаболический синдром способствует усилению окислительного стресса в кардиомиоцитах при гипоксии/реоксигенации. Полученные результаты позволяет выдвинуть гипотезу о том, что окислительный стресс может быть причиной низкой эффективности адаптационных процедур и агонистов мю-опиоидных рецепторов при метаболическом синдроме. Могут ли в данной ситуации антиоксиданты улучшить эффективность? Этот вопрос предстоит исследовать в дальнейшем.
Вторым этапом работ стал поиск новых молекулярных мишеней для кардиопротекции на основе знаний о механизме хронической нормобарической гипоксии: изучение роли аденозиновых, брадикининовых, каннабиноидных, GLP-1 рецепторов и рецепторов к урокортину-2 и лептину в реализации кардиопротекторного эффекта адаптации к хронической нормобарической гипоксии у крыс с метаболическим синдромом и без него.
Скрининг показал, что аденозиновые, каннабиноидные рецепторы, рецепторы к GLP и урокортину-2 не вовлечены в инфаркт-лимитирующий эффект адаптации к хронической гипоксии. Исследователи обнаружили, что активация В2-брадикинировых рецепторов у крыс с нормальным метаболизмом, но не при метаболическом синдроме, участвует в реализации инфаркт-лимитирующего действия адаптации к хронической гипоксии. Нарушение сигналлинга лептина может играть негативную роль в нарушении адаптационной кардиопротекции при адаптации к хронической гипоксии.
Исследование ученых лаборатории экспериментальной кардиологии будет продолжено в направлении поиска новых мишеней для кардиопротекции на основе знаний о механизме кардиопротекторного действия другого адаптирующего воздействия – гипоксического прекондиционирования. Это воздействие моделируется 6-ю кратковременными (по 10 минут) сеансами гипоксии, при которых крыса помещается в атмосферу 8% кислорода, с последующей реоксигенацией атмосферным воздухом. Подобное воздействие приводит к снижению размера инфаркта при последующей коронароокклюзии на 30%. Однако его механизмы остаются малоизученными. Неизвестно, эффективно ли подобное воздействие при наличии метаболического синдрома.
Еще одной областью для поиска кардиопротекторных мишеней является исследование путей клеточной гибели. Известно, что при воздействии ишемии клетки миокарда гибнут как путем некроза, так и через регулируемые механизмы: апоптоз, пироптоз, некроптоз, аутофагия и многие другие, воздействие на которые может спасти клетки миокарда от гибели. Остается неисследованным вопрос: какие из механизмов клеточной гибели изменяются при адаптации, возможно ли имитировать этот эффект фармакологически. На этот и другие вопросы научного поиска ученым предстоит найти ответы в своих дальнейших исследованиях в рамках проекта.
В исследовательском проекте принимали участие молодые ученые лаборатории экспериментальной кардиологии НИИ кардиологии Томского НИМЦ: Никита Воронков, Борис Курбатов, Михаил Килин, Артур Кан, Александр Граб.
- Исследование поддержано грантом РНФ №22-15-00048-П.
